Çözünme – çökelme dengesi konusuna geçmeden önce bazı tanımları bilmemiz gerekir. Bunlar çözünürlük, molar çözünürlük, doygun çözelti. Şimdi bunların tanımlarına bakalım.
→ Sabit sıcaklık altında 100 gram çözücüde çözünebilen en fazla madde miktarına Çözünürlük denir.
→ Sabit sıcaklık altında 1 litre doygun çözeltide çözünmüş madde miktarına
[I]Molar Çözünürlük[/I] denir.
[SIZE=22px]
Çözünme – Çökelme Dengesi ve Çözünme – Çökelme Tepkimeleri[/SIZE]
Çözünme olayı kimyasal olabileceği gibi fiziksel de olabilir. Aşağıda verilen şekilde sabit sıcaklıktaki saf suya sudaki çözünürlüğü endotermik olan PbCl2 katısı eklenmiştir. Burada zamanla çözünme gerçekleşecektir ve çözelti doyacaktır. Şimdi çözünme – çökelme dengesi konusunu bu şekil üzerinden anlatmaya çalışacağız.
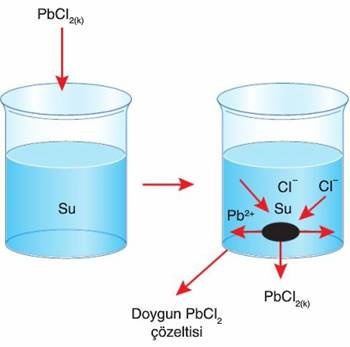
Kapta başlangıçta hem düzensizlik eğilimi çözünmeyi destekleyecek hemde minimum enerjiye eğilim çökmeyi destekleyecek. Çözünen maddenin iyonları birbirleri ile çarpıştıkları gibi maddenin yüzeyine de çarparlar. Bu maddenin yüzeyine çarpan taneciklerden yavaş ve kinetik enerjisi düşük olanlar madde yüzeyinin çekim kuvvetinden kurtulamazlar ve maddeye yapışırlar.
Bir süre sonra ise çözünme ve çökelme hızları birbirlerine eşit olur ve çözelti dengeye ulaşılır. Böylece Doygun Çözelti oluşmuş olur. Doygun çözeltide, çözeltiye geçen ve çöken iyonlar arasında kurulan dengeye ise
[I]Çözünme – Çökelme Dengesi[/I] denir.


